連結して氷の成長を止める不凍タンパク質BpAFPを発見
背景:
凍る瞬間の水中には無数の氷の単結晶(氷核)が発生します。それらの氷核が周囲の水を取り込みながら成長と融合を繰り返したものが、私達が目にする氷です。実は、この一見何でも無い水の凍結過程が、冷凍食品や凍結細胞の内部構造を変化させ、それらの品質や生存率を低下させてしまう原因になっています。もしも氷核の融合と成長を阻止することができれば、野菜、果実、加工食品、パン類、麺類、清涼飲料、医療品、試薬、化粧品、顔料、細胞、組織、臓器等を品質や生命力を損なわずに凍結する新技術ができると考えられています。液体窒素(-196℃)にも氷核の成長融合を抑制する効果がありますが、コストがかかり危険が伴うため、これに代わるより安価で安全な冷凍技術の開発が望まれていました。不凍タンパク質(Antifreeze Protein、略称AFP)は、0℃より少しでも低い温度であれば、氷核に結合してその成長と融合を抑制する性質を有します。特に、氷核の全面に結合できる高機能型AFPは強く氷核の融合と成長を止めると考えられる為、世界中で研究開発が行われていました。
研究手法:
北海道に生息する魚類から特許技術によりAFPを取得しアミノ酸配列を解析したところ、新しい種類であることが判明しました(BpAFPと命名)。ゴルフボール大の氷核の球を作成し、蛍光物質を付加したBpAFP遺伝子組換え体の水溶液の中に浸すことで、氷核のどの結晶面にBpAFPが結合するかを解析しました(FIPA実験と呼びます)。更に、凍結ステージ付き顕微鏡システム、円偏光二色性、超遠心、NMR、X線等を用いてBpAFPの分子構造と氷結晶結合機能を詳しく調べました。
研究結果:
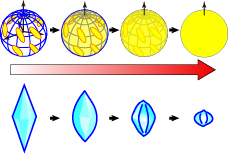
BpAFPは連続したアラニンを多く含む40アミノ酸残基の分子であり、表面にスレオニン(T)と呼ばれるアミノ酸残基を等間隔で配置したαらせん型分子であると推察されました。この構造は100℃に加熱後も維持され、強酸や強塩基にも耐性を示しました。更に、BpAFPは60%(質量パーセント濃度)もの高濃度で水に溶け4量体や8量体を形成することが判明しました。FIPA実験を行うと(図上段)、BpAFPの濃度が低いときには氷核球の特定の部分だけが縞模様に光るものの、濃度を高めるに連れて次第に全氷結晶面が光る様に変化することが分かりました。実際にBpAFPの水溶液を顕微鏡下で凍らせて氷核を調べてみると(図下段)、先のとがったバイピラミッド型から丸みを帯びたレモン型に濃度依存的に変化し、そのサイズも次第に小さくなりました。これらの結果から、BpAFPは低濃度では氷核の一部(ピラミダル面と呼びます)に結合するものの、濃度に応じて分子同士が連結することで全氷結晶面に結合を拡大させて行き、高濃度では氷結晶を完全に覆い尽くす特別な性質をもつと結論付けられました。液体窒素ではなく、BpAFPを用いることで小さな氷核で埋め尽くすように水を凍結させることが出来るかどうかを、更に詳しく調べて行きたいと考えています。
研究者氏名: マハタウッディン・シェイク、花田祐一、西宮佳志、三浦 愛、
Peter L. Davies、津田 栄
生命科学専攻(生命融合科学コース) 連携分野 分子適応科学
研究室(産総研)
論文題目, 掲載誌:
Concentration-dependent oligomerization of an alpha-helical
antifreeze polypeptide makes it hyperactive. (2017)
Scientific Reports 7, 42501. DOI: 10.1038/srep42501.
連携分野のプレスリリースURL:
http://www.aist.go.jp/aist_j/new_research/2017/nr20170216/nr20170216.html