ALS/FTD の原因となるTDP-43断片凝集体形成機構を解明(先端生命科学研究院・北村 朗 講師)
北海道大学大学院先端生命科学研究院の北村 朗講師、同大学大学院生命科学院博士後期課程 3 年の藤本 愛、米国ノースウェスタン大Richard Morimoto教授らの研究グループは、筋萎縮性側索硬化症(ALS)や前頭側頭型認知症(FTD)の原因となる TDP-43 カルボキシ末端断片の細胞内凝集体形成機構を明らかにするとともに、モデル生物である線虫を用いて凝集体による毒性を実証しました。
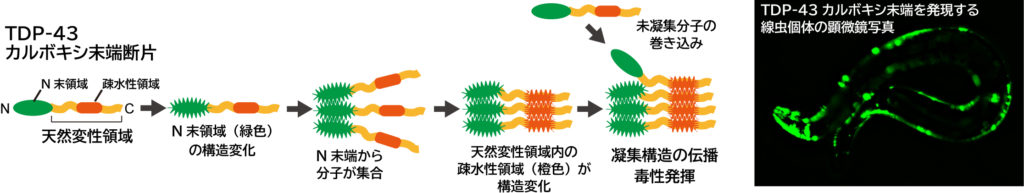
TDP-43カルボキシ末端断片の凝集モデル(左)とそれを発現する線虫の顕微鏡写真(右)
本成果では、TDP-43 カルボキシ末端断片が凝集する時、どの領域がどういう推移で凝集していくのかを、ドメイン欠損変異体やドメイン交換変異体などを使って明らかにしました。具体的には、TDP-43 カルボキシ末端断片の N 末端ドメインが最初に構造変化した後、分子間の会合が起こります。それにより、C 末端側の元来構造を取らない天然変性領域が構造変化することで、まだ構造変化していないTDP-43カルボキシ末端断片や細胞内のタンパク質を巻き込んでアミロイドを含む凝集体を形成します。
また、光により時空間を制御しつつタンパク質の会合を誘導できるタグを用いた解析により、TDP- 43カルボキシ末端断片の天然変性領域の N 末端側は近接しやすいのに対し、C 末端側は近接しにくいことも示唆されました。さらに、有名なモデル生物である線虫にTDP-43カルボキシ末端断片を発現させると、線虫内でも凝集体を形成しますが、流動性の低い凝集体を形成する線虫では運動性の低下が起こり、短寿命となることが分かりました。将来的には、本研究で確立した手法が利用してTDP- 43カルボキシ末端断片の凝集形成を抑える薬剤評価を行うことで、ALSやFTDの治療または予防戦略に期待が持たれます。
なお、本研究成果は、2024 年 6 月 20 日(木)公開の Communications Biology 誌にオンライン掲載されました。
詳細は以下をご覧ください。
北大プレスリリース:ALS/FTDの原因となる凝集体形成機構を解明~神経細胞の毒となるタンパク質凝集を抑制する薬剤などの研究発展に期待~
論文名 Hetero-oligomerization of TDP-43 carboxy-terminal fragments with cellular proteins contributes to proteotoxicity (TDP-43 カルボキシ末端断片と細胞内タンパク質のヘテロオ リゴマー形成はタンパク質毒性に寄与する)
著者名 北村 朗 1*、藤本 愛 2*、川島怜維 2(研究当時)、Yidan Lyu2(研究当時)、佐々木虎徹 2、濱田悠太 2、 森谷香南 2(研究当時)、倉田歩実 3(研究当時)、高橋一帆 3(研究当時)、Reneé Brielmann4、Laura Bott4、 Richard Morimoto4、金城政孝 1(1 北海道大学大学院先端生命科学研究院、2 北海道大学大学 院生命科学院、3 北海道大学理学部、4 米国ノースウェスタン大学、*筆頭共著者)
雑誌名 Communications Biology (英国 Nature Publishing Group 発行の生物・医生物学術誌)
DOI 10.1038/s42003-024-06410-3
公表日 2024 年 6 月 20 日(木)(オンライン公開)