HIV-2のエイズ発症遅延のメカニズムを解明~2型ヒト免疫不全ウイルス(HIV-2)のNefタンパク質構造からエイズ発症機序を探る~
北海道大学大学院薬学研究院の前仲勝実教授・黒木喜美子准教授らの研究グループは,エイズ発症の主原因となっているヒト免疫不全ウイルスHIV-1と多くの感染者に対してエイズ症状を発症しにくいHIV-2について,HIV-2でエイズ発症が遅延するメカニズムを解明しました。
研究グループは,HIV-1とHIV-2のタンパク質機能・構造の差異と宿主免疫制御との関連を理解することで,理論的なHIVワクチンデザインを目指しています。HIV-2はHIV-1と配列相同性が高く,機能的にも多くの共通点を持つ一方で,感染者の多くが自己の免疫機構によりウイルス複製・増殖をコントロールできます。そのため,感染者はエイズを発症しにくく,主に西アフリカで局所的に存在するウイルスです。HIVがコードするタンパク質のうち,Nefタンパク質はヒトの免疫系受容体であるとともに,ウイルスレセプターであるCD4,CCR5,CXCR4発現低下によりウイルスの再感染を防ぐほか,MHCクラスIの発現低下によりT細胞免疫から逃避させたりすることで広くウイルス複製促進に寄与しています。これまでにHIV-1とHIV-2のNefタンパク質は多くの共通機能を持つ一方で,機能上異なる点があることも報告されてきました。
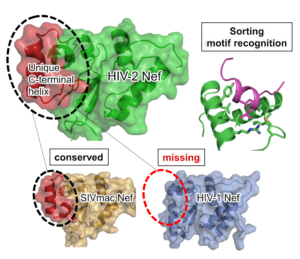
本研究では,HIV-2Nefタンパク質及び機能的に類似しているサル免疫不全ウイルスSIVNefタンパク質コア領域全長の立体構造を明らかにすることで,これまでに報告されてきた機能的差異についての構造的な理解に成功しました。HIV-2とSIVNefタンパク質は,C末端領域にHIV-1が持たないαヘリックス構造を持ち,この領域の配列はウイルスゲノムの中で変異が入りにくいため,ウイルスにとって重要な構造領域であることが示唆されました。実際に,このC末端αヘリックス構造は,MHCクラスI発現低下誘導時に形成されるMHCクラスI/AP-1/Nefタンパク質の複合体構造形成において立体障害を起こさないことがわかりました。また,HIV-2はSIVNefタンパク質のCD3結合領域との構造保存性が高い一方でHIV-1とは保存性が低く,HIV-2とSIVのみがT細胞受容体-CD3複合体に結合し,発現量を低下させるという知見に矛盾しない構造であることがわかりました。
今後,HIV-2Nefタンパク質とHIVNefタンパク質の構造・機能の差異を理解することによって,HIV-1ワクチンデザインにおける新規ターゲットとしてのNefタンパク質の可能性を検討していきたいと考えています。
なお,本研究成果は,2019年12月9日(月)のiScience誌にオンライン掲載されました。
論文情報
論文名 Structure of HIV-2 Nef reveals features distinct from HIV-1 involved in immune regulation(HIV-2 Nef の立体構造から宿主免疫制御に関与する HIV-1 とは異なる特徴を発見)
著者名 平尾憲吾 1,Sophie Andrews2,黒木喜美子 1,日下裕規 1,田所高志 1,喜多俊介 1,尾瀬農之 1,3,Sarah L. Rowland Jones2,前仲勝実 1(1北海道大学大学院薬学研究院,2オックスフォード大学,3北海道大学大学院生命科学院)
雑誌名 iScience(一般科学誌)
DOI 10.1016/j.isci.2019.100758
公表日 2019 年 12 月 9 日(月)(オンライン公開)